
|
Experiment des Monats
|
Halogenkohlenwasserstoffe können in wässriger Lösung Halogenid-Ionen freisetzen. Diese lassen sich als Silberhalogenide nachweisen. Die Dissoziation ist dabei abhängig von der Art des Halogens und der Bindungsstelle.
 |
Geräte und Chemikalien:
Reagenzgläser, Tropfpipetten, 100 ml Becherglas;
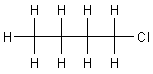
1-Chlorbutan,
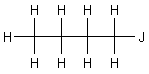
1-Iodbutan,
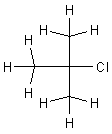
tert.-Butylchlorid,
Chlorbenzol,
Benzylchlorid,
0,1 M Silbernitrat-Lösung,
Ethanol.
Durchführung:
Die Reagenzgläser mit einer alkoholischen Silbernitratlösung füllen
(5 ml Ethanol + 1 ml AgNO3-Lösung).
Nun jeweils einige Tropfen der verschiedenen Halogenkohlenwasserstoffe zugeben:
1-Chlorbutan - 1-Iodbutan - tert.-Butylchlorid - Chlorbenzol - Benzylchlorid
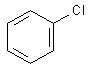
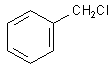
In Reagenzglas 3 und 5 bildet sich ein weißer Niederschlag, in Reagenzglas 2
ein gelblicher.
Erklärung:
Die größeren Halogene können leichter abgespalten werden, da
größere Atome leichter polarisiert werden und die Bindungen, durch den
größeren Abstand, schwächer sind. Für die Bindungsstärken
gilt daher: C-I < C-Br < C-Cl < C-F.
Die Bindungen werden umso leichter gespalten, je stabiler das entstehende
Carboniumion ist. Tertiäre Carboniumionen sind besonders stabil; ebenso
Benzyl-Ionen, bei denen die positive Ladung über das aromatische System
stabilisiert werden kann.
Bei der Reaktion läuft letztlich eine Nucleophile Substitution ab
(nach SN1- oder SN2-Mechanismus):
R-X + H2O
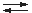 R+ + X– + H2O
R+ + X– + H2O
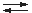 R-OH + H+ + X–
R-OH + H+ + X–
Gefahren:




Alle Halogenalkane sind umweltgefährend und dürfen daher keinesfalls
ins Abwasser gelangen! Benzylchlorid ist giftig und cancerogen; Ethanol und die
Chlorbutane sind leichtentzündlich, Iodbutan und Chlorbenzol
gesundheitsschädlich. Silbernitrat ist ätzend.
Entsorgung:
Die Lösungen müssen als halogenierte organische Abfälle entsorgt werden.
Literatur & Links:
F. Bukatsch, W. Glöckner: "Experimentelle
Schulchemie", Bd. 7 - Versuch 26/27, S. 22-23
Gregor Fels, Univ. Paderborn: persönliche Mitteilung
Frank H. Wedekind: chemielehrer.de (1997)
Am Fachbereich Chemie der Universität Paderborn (AK Prof. Fels) ist zu diesem Experiment ein Video (Real-streaming) verfügbar.
Frau Silke Heuser, Institut für Didaktik der Chemie, J.W.Goethe-Universität Frankfurt am Main, danke ich sehr herzlich für die Unterstützung.
 zurück zum aktuellen Experiment
zurück zum aktuellen Experiment
Seite erstellt am: Montag, 30. April 2007, A. Schunk, Institut für Didaktik der Chemie, Johann Wolfgang Goethe Universität Frankfurt am Main.
Für den Inhalt externer Seiten wird keine Verantwortung übernommen!